【この記事のポイント】
- CRISPR/Cas9は「DNAの切り貼り」。次世代技術CRISPR-Tn(CAST)は「DNAの正確な書き込み」。
- CASTは、CRISPRのナビゲーション能力とトランスポゾン(転移因子)の組み込み能力を融合させたシステム。
- これにより、従来のゲノム編集では難しかった大きなDNA配列のゲノムへの正確な挿入が可能になる。
Ⅰ. はじめに:ゲノム編集技術の現状と課題
21世紀の生命科学における最も偉大な発見の一つが、間違いなくCRISPR/Cas9システムでしょう。この技術は、細菌が持つ免疫システムを応用したもので、「生命の設計図」であるDNAを狙った場所で切断し、細胞が持つ修復メカニズム(非相同末端結合:NHEJ、または相同組換え:HDR)を利用して、遺伝子の破壊(ノックアウト)や、新しい配列の挿入(ノックイン)を可能にしました。
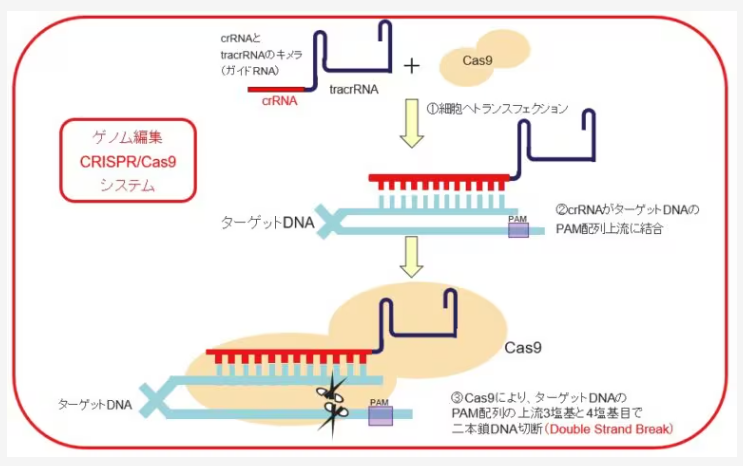
CRISPRの登場は、遺伝子治療、農業、基礎研究に革命をもたらしましたが、Cas9を中心とする従来のゲノム編集には、超えがたい課題も存在します。
🔹 従来のゲノム編集が抱える「切断のジレンマ」
Cas9は標的DNAを切断(二本鎖切断:DSB)することが基本です。この切断がなければ、挿入もノックアウトも始まりません。
- 切断エラー(インデル): NHEJによる修復はエラーを起こしやすく、意図しない塩基の欠失や挿入(インデル)を引き起こします。これがノックアウトには有効ですが、正確な遺伝子修復には不向きです。
- 挿入の非効率性: 狙った場所に新しい遺伝子配列(ドナーDNA)を挿入するノックイン(HDR)は、効率が非常に悪く、特に大きな配列を挿入しようとすると、その難易度は跳ね上がります。細胞の修復メカニズムに依存するため、望む配列がランダムに組み込まれてしまうリスクもありました。
この「切断のジレンマ」を克服し、ゲノムを「正確に書き込む」技術として、生命科学の最前線で急速に注目を集めているのが、まさに特許文書の背後にある技術、CRISPR-Tn(CAST)システムです。
Ⅱ. CRISPR-Tn(CAST)システム
ゲノム編集のパラダイムシフトを示す最先端技術として、従来のCRISPR/Casシステムが、切断を行わない非典型的経路(Noncanonical pathways)へと進化し、特に「CRISPR-associated transposon (CRISPR-Tn or CAST) systems」という形で、トランスポゾン関連タンパク質と組み合わされることが挙げられます。
🔹 CASTシステムの基本原理:ナビゲーションと組み込みの融合
CASTは、CRISPRとトランスポゾン(Transposon)を組み合わせたシステムです。トランスポゾンとは、通称「動く遺伝子」とも呼ばれ、ゲノム内のある場所から別の場所へ、自律的に移動・挿入できるDNA配列と、それに関わる酵素(トランスポザーゼ)の複合体です。
CASTシステムの革新性は、この二つの機能を融合した点にあります。
- CRISPR/Casの役割: 道案内(ナビゲーション)。crRNA(ガイドRNA)を使って、ゲノム上の狙いたい特定のターゲット配列を極めて高い特異性で正確に見つけ出します。
- トランスポザーゼ(Tn)の役割: 正確な書き込み(インサーション)。Casタンパク質が標的を認識した後、トランスポザーゼがDNA切断を伴わずに、数十キロベース(kb)に及ぶ大きなDNA断片(ペイロード)を、その狙った場所に正確に挿入します。
従来のCas9が「ハサミ」と「セロハンテープ」に頼っていたのに対し、CASTシステムは、「高精度GPSナビゲーションシステム」と「高性能な自動書き込みペン」を組み合わせたようなものです。これにより、切断によるエラーを最小限に抑えつつ、効率よく、そして正確に、目的の遺伝情報をゲノムに「書き込む」ことが可能になります。
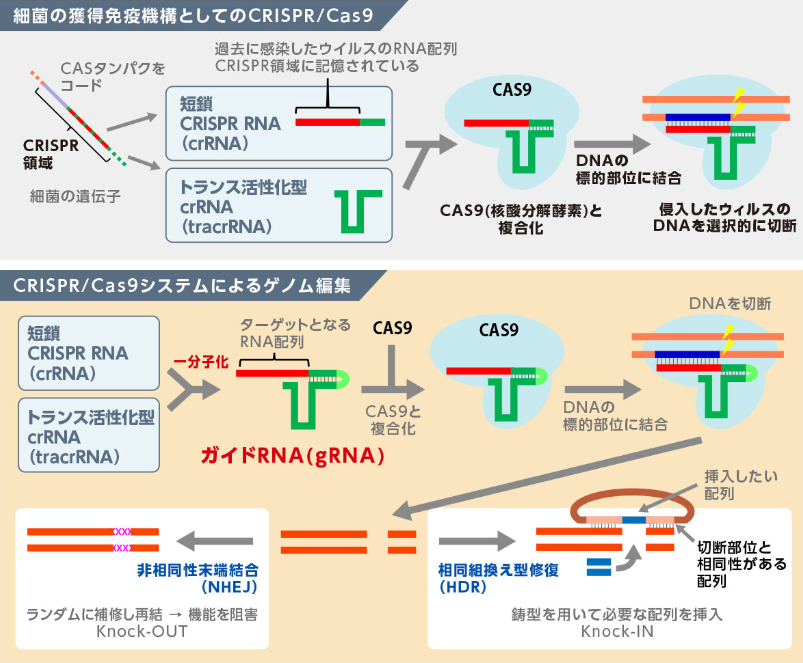
🔹 CASTシステムの構成要素とメカニズム
CASTシステムは、Type I-F-TnやType V-K-Tnなど、様々なタイプがありますが、多くのCASTsは、従来のCRISPRシステムからヌクレアーゼ活性(DNA切断能力)が欠損しているのが特徴です。
| 構成要素 | 役割 |
| Casタンパク質複合体 | 標的認識とトランスポザーゼの動員(リクルートメント)を担当。切断機能は持たない。 |
| ガイドRNA(crRNA) | 標的配列の相補鎖を認識し、Cas複合体を導く。 |
| トランスポゾン関連タンパク質 (TnpA, TnpB, TnsCなど) | トランスポザーゼ活性を持ち、ペイロードDNAの切断と標的ゲノムへの組み込みを触媒。 |
| ペイロードDNA | ゲノムに組み込みたい新しい遺伝子(数十kbの長鎖も可能)がトランスポゾン配列に挟まれたもの。 |
CASTシステムによる挿入の鍵は、ターゲットサイト特異的インサーション(Target-Site Specific Insertion)が起こる点です。Cas複合体が標的を認識し、トランスポザーゼ複合体をリクルートした後、トランスポザーゼは標的部位に一本鎖切断(ニック)を入れ、DNA切断を伴わずにペイロードDNA全体をそのニックの間に挿入します。このメカニズムは、切断後の細胞のランダムな修復(NHEJ)に依存せず、DNA修復の必要性が低いため、非分裂細胞や特定の細胞種でも高い効率を発揮できると期待されています。
Ⅲ. CAST技術の応用可能性:正確な「書き込み」が拓く未来
CASTシステムが従来のゲノム編集を超える最大のアドバンテージは、「大きなDNA断片を高効率かつ正確に、狙った場所に挿入できる」点にあります。この能力は、単なる遺伝子の破壊や小さな修復を超え、生命の設計図を丸ごと「プログラミング」するレベルの応用を可能にします。
🔹 遺伝子治療のブレイクスルー:次世代の治療法へ
現在の遺伝子治療の多くは、遺伝子欠損を補うためにウイルスベクターを用いていますが、挿入効率やゲノムへのランダムな組み込みによる安全性(発がん性リスク)が課題でした。
CASTシステムは、この課題を一挙に解決する可能性を秘めています。
- 単一遺伝子疾患の完治: 遺伝子欠損が原因の疾患に対し、数十kbにも及ぶ正常な遺伝子全体を、CRISPRのナビゲーションで安全性の高い「ゲノムの指定席」に正確に挿入できます。これにより、長期的な遺伝子発現と恒久的な完治が期待されます。
- 非分裂細胞への適用: 従来のHDRに依存したノックインは、細胞分裂中の細胞(分裂細胞)でしか高効率で起こりませんが、CASTはDNA修復に依存しないため、神経細胞や肝細胞などの非分裂細胞においても高い効率での遺伝子挿入が期待されています。
- 多遺伝子導入: 複数の遺伝子や、複合的な代謝経路全体など、長いDNAシーケンスを一度に効率よく組み込むことができるため、複雑ながん免疫療法(CAR-T細胞療法など)の細胞改変や、再生医療用の高性能細胞の作製などにも応用が広がります。
🔹 合成生物学とバイオファウンドリ:微生物を設計する
合成生物学とは、生物の持つ機能を工学的に再設計したり、自然界には存在しない新しい機能を持つ生命体を作り出したりする分野です。特に、微生物(酵母やバクテリア)に特定の遺伝子を組み込み、医薬品原料やバイオ燃料、高機能素材などを生産させるバイオファウンドリにおいて、CASTは不可欠な技術となります。微生物のゲノムに長い代謝経路全体を、高効率かつエラーなく「プログラミング」することで、高性能な「細胞工場」を迅速に開発することを可能にします。
🔹 農業・畜産への応用:強靭な作物開発
作物の品種改良においても、耐病性、耐塩性、収量向上といった複数の特性を同時に支配する遺伝子群を、パッケージとして正確に挿入できます。複数の有用遺伝子をゲノムの特定部位に効率的に集積させる遺伝子スタッキング(Gene Stacking)が可能となり、環境変化に極めて強靭で、かつ収量の高い「スーパー作物」の開発期間を大幅に短縮できます。
Ⅳ. 実用化に向けた課題と展望:次世代技術の「壁」
CASTシステムは大きな可能性を秘めていますが、実用化と普及に向けては、まだ超えるべきいくつかの技術的な壁が存在します。特許の観点からも、これらの課題解決策に多くの発明が生み出されています。
🔹 課題1:挿入効率の向上とオフターゲット挿入の制御
CASTシステムの細胞種による効率はまだ課題であり、特にヒト細胞における効率(初期の報告では1%未満から、進化工学的手法(evoCAST)により最大30%程度まで向上)のさらなる最適化が求められています。また、従来のCas9の切断毒性は回避できますが、オフターゲットインテグレーション(意図しない場所への挿入)のリスクは依然として存在します。このリスクを最小化するため、Casタンパク質やトランスポザーゼ自体の酵素工学的な改良が活発に進められています。
🔹 課題2:送達(デリバリー)技術の確立
CRISPR技術全般に言えることですが、生体内でCASTシステムの構成要素(Casタンパク質、ガイドRNA、トランスポザーゼ、ペイロードDNA)を目的の細胞・組織に安全かつ効率的に届ける「送達技術」が最大のボトルネックです。CASTシステムは、従来のCas9よりも積載するペイロード(数kb〜数十kb)が大きいため、既存のデリバリー技術(AAVベクターや脂質ナノ粒子LNPなど)をCASTシステムの巨大なサイズに対応させるための設計が不可欠です。
🔹 課題3:生物学的制御と安全性(トランスポゾン活性の管理)
CASTシステムは、元々「動く遺伝子」であるトランスポゾンを利用しています。一度CASTシステムを投与した後、トランスポザーゼがゲノムに残り続け、意図しない場所で転移を再開してしまうリスク(持続的活性)を排除するため、自己不活性化(Self-inactivating)するシステム設計や、特定のプロモーターによる厳密な活性制御が、安全性を確保する上で重要となります。
【未来の展望】
これらの課題が解決されれば、CASTシステムは、基礎研究から臨床応用へと急速に移行するでしょう。特に、「ゲノムを正確に書き換える能力」は、遺伝子治療を一回限りの注射で完結させる「ワンショットキュア」の時代を切り開き、従来の医薬品開発の概念を根本から変える可能性を秘めています。
Ⅴ. 未来の「生命の設計図」エンジニアリング
ゲノム編集の技術は、Cas9の発見からわずか10年強で、「切断」から「編集」、そして今や「プログラミング(書き込み)」へと劇的な進化を遂げています。
CRISPR-Tn(CAST)システムは、まさにこの「書き込み」を担う次世代の主役です。生命の設計図に、必要な情報を、必要な大きさで、エラーなく、正確に挿入できるこの技術により、ヒトの難病治療から、持続可能な食糧生産まで、生命の根幹を刷新するイノベーションが誕生する日も遠くないかもしれません。

Ⅵ. 特許情報と参考文献
本技術分野に関連する、すでに公開されている特許文献と、主要な参考文献を紹介します。
🔹 関連する公開特許文献(Google Patentsより)
| 特許番号 | 発明の名称(概要) | 発明者/出願人 | ポイント |
| US11,286,554 B2 | CRISPR-ASSOCIATED TRANSPOSE SYSTEMS AND METHODS OF USE | Broad Institute, Inc. 他 | CASTシステム(特にType I-FやType V-K)の構成要素と、標的特異的なインサーションを行うための方法論について詳細に開示しており、本技術の基礎を確立した重要な特許。 |
| US2023/0073289 A1 | COMPOSITIONS AND METHODS FOR SITE-SPECIFIC INTEGRATION OF NUCLEIC ACIDS USING CRITERIA-ASSOCIATED TRANSPOSASES | The Regents of the University of California | CASTシステムを利用し、特にヒト細胞で効率的なRNA誘導型遺伝子挿入を実現するために、トランスポザーゼを進化工学的に改良したevoCASTシステムについて言及。 |
| US2020/0190487 A1 | CRISPR-ASSOCIATED TRANSPOSASE SYSTEMS AND METHODS OF USE THEREOF | Massachusetts Institute of Technology, Broad Institute Inc. | CRISPR-Cas複合体(ヌクレアーゼ欠損型)とトランスポザーゼを組み合わせた、非相同組換えに依存しないサイトスペシフィックな遺伝子挿入技術に関する特許。 |
🔹 参考文献
- Vo, T. V., & Doudna, J. A. (2022). Programmable DNA insertion using CRISPR-associated transposons. Annual Review of Biochemistry, 91, 237-258. (CASTシステムの包括的なレビュー)
- Klompe, S. E., et al. (2019). RNA-guided DNA insertion with CRISPR-associated transposons. Nature, 571(7764), 218-223. (CASTの機能実証に関する初期の重要な研究)
- Strecker, J., et al. (2019). RNA-guided DNA integration in bacteria and in human cells using a CRISPR-associated transposase. Science, 365(6460), 145-150. (ヒト細胞への初期応用を示した研究)
- Wang, G. et al. (2023). Continuous evolution of CRISPR-associated transposases for efficient, RNA-programmed gene insertion into the human genome. Nature Biotechnology, 41, 107-118. (evoCASTシステムの開発と効率向上に関する論文)